|
|
细胞因子风暴与移植二三事
来源:移诺时代 2020年3月10日
当发生大规模的传染性疾病时,人们通常认为来自外界的病原体是他们最大的“敌人”,殊不知,最致命的“杀手”不在外界,而在于失控的自身免疫系统。即由于病毒的大量扩增或者免疫系统的过度应答导致的细胞因子级联反应,如果没有及时的干预处理,严重者将发展为多器官衰竭甚至死亡——临床专家和免疫学家们将这样一个过程称为细胞因子风暴(Cytokine storm)。值得注意的是,它并不是一个独立的疾病诊断,而是多种因素导致免疫系统过度激活引起细胞因子急剧释放启动级联反应的病理状态。
由于对COVID-19重症患者的持续关注,细胞因子风暴的发生机制和应对处理也备受关注。今天小诺就另辟蹊径来和大家聊一聊在移植领域中是否也会发生细胞因子风暴。
细胞因子风暴的前世今生
“细胞因子风暴”一词最早在1993年由Ferrara在Bone marrow杂志中提出,用以描述患者造血干细胞移植术后GvHD的一种免疫应激状态。
图1 细胞因子风暴大事记
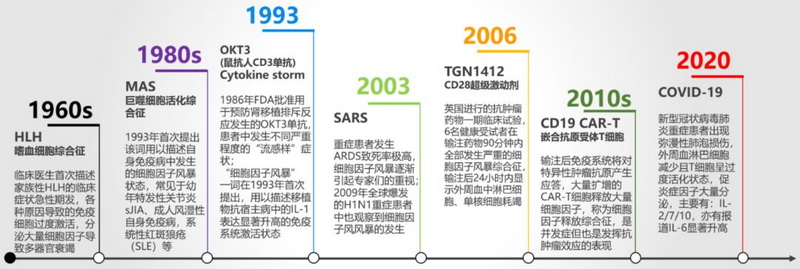
90年代随着生物制剂的发展,鼠源性单抗OKT3(1986年FDA批准用于肾移植)引起的人抗鼠反应逐渐进入人们的视野,患者输注OKT3后出现不同严重程度的人抗鼠反应,表现为“流感样”症状,血清中IFN-γ、TNF-α、IL-2显著增高。单抗类药物引起的细胞因子风暴更严重的则发生在2006年在英国开展的抗肿瘤一期临床试验中,6名健康志愿者输注TGN1412后全部发生了严重的系统性炎症反应,出现多器官衰竭以及弥散性血管内凝血。
2003年SARS-CoV病毒感染病例中,大量浸润的炎症细胞连同急剧增高的炎症因子攻击患者的血管内皮细胞和呼吸道上皮细胞,引起急性肺损伤,对SARS患者血清的检测也证实了细胞因子风暴的发生。2009 年甲型H1N1 流感病毒导致的ARDS,同样以失控的过度炎症为特征。由此,病毒感染引起的细胞因子风暴也受到了科学家的关注。
随着COVID-19爆发,科学家们也针对重症感染患者进行了相关研究。2020年1月14日,中南医院团队在Lancet上发表文章,分析了重症患者血清中细胞因子的表达,大量分泌的IL-2/7/10、GSCF、TNF-α等细胞因子提示患者经历了不同程度的细胞因子风暴。目前尚无特别有效的药物来预防细胞因子风暴的发生,主要是通过大剂量糖皮质激素或者IL-2R拮抗剂、JAK抑制剂、TNF-α抑制剂等结合相应的支持治疗来缓解。
细胞因子风暴综合征 VS 细胞因子释放综合征
除了细胞因子风暴综合征之外,我们还常常在文献中看到细胞因子释放综合征,二者有何异同呢?
总体而言,细胞因子风暴综合征( Cytokine storm syndrome, CSS )一般用来描述不依赖于肿瘤靶点的免疫系统激活,最常见的诱因便是感染(流感病毒、埃博拉病毒、人疱疹病毒,巨细胞病毒等)、造血干细胞移植后GvHD以及某些治疗性抗体如OKT3、TGN1412、PD-1抑制剂等,这些都可导致患者发生全身性炎症反应及血液动力学改变,体内促炎症因子急剧升高,且淋巴细胞、单核细胞呈耗竭状,患者很快进展为多器官衰竭甚至死亡。值得注意的是,不同的病毒或者不同的单抗类药物引起的细胞因子风暴过程和特点虽然相似,但具体的主要介导因子和免疫细胞并不尽相同。
而细胞因子释放综合征(Cytokine release syndrome, CRS)则主要用来描述肿瘤靶向治疗引起的免疫系统异常激活,如抗人CD19-CART及anti-CD3&CD19特异性双抗的应用,表现为输注后1至14天延迟出现的恶心、头痛、心动过速、气促、低血压、皮疹等临床症状10。(贴心的小编在这里为大家整理二者的异同点,见下表)。
表1 细胞因子风暴综合征(CSS)和细胞因子释放综合征(CRS)的异同

细胞因子风暴综合征的病理生理机制
当患者感染病毒(通常为:流感病毒/SARS-CoV/COVID-19)后,肺上皮细胞和肺泡巨噬细胞开始分泌促炎症因子和趋化因子(以IFNs为主);巨噬细胞随后激活树突状细胞(DC)发育成熟为抗原提呈细胞(APC)传递抗原信号,由此,抗病毒应答进入适应性免疫阶段,机体的炎症反应得到放大。携带病毒抗原的APC迁移至次级淋巴器官激活T细胞分化为效应T细胞,后者开始表达分泌多种细胞因子(IFN-γ、TNF-α、IL-2/6/12/10、IP10)和趋化因子攻击上皮细胞,另一方面,大量进入血液的趋化因子又引起更多的炎症细胞(淋巴细胞、单核细胞、粒细胞)趋化至炎症部位发挥效应,机体的炎症反应得到正反馈刺激,在某些情况下,便发展为不可控的细胞因子风暴。(下图示流感病毒感染引起的细胞因子风暴发生机制)
图2 流感病毒感染引起的细胞因子风暴发生机制

器官移植受者会发生细胞因子风暴吗?
(一)造血干细胞移植
“细胞因子风暴”一词最早用于描述机体发生GvHD时的炎症状态。在异基因造血干细胞移植(allo-HSCT)中,急性GvHD是术后主要致死原因之一,发生率视预处理方案和后续GvHD的预防用药、研究者的判断标准等有所不同,为20~70%不等,以GI-GvHD(胃肠道移植物抗宿主病)多见。另外,脐带血移植(Cord blood transplantation, CBT)后患者发生PES(Pre-engraftment syndrome, 植入综合征)主要也是由于细胞因子风暴的发生所致。
其发病机制简而言之就是:移植前预处理方案损伤受者肠粘膜或肝脏,激活组织细胞分泌前炎症因子TNF-α、IL-1,上调受者体内趋化因子和MHC抗原,这些增强的抗原信号被来自供者的T细胞(异基因反应性T细胞,allo-reactive T cells)识别,经由JAK/STAT信号通路转导后,供者T细胞活化增殖分泌大量产物,最终与其它炎症细胞以正反馈的作用形式引起细胞因子风暴的产生,使受者靶器官受到持续的攻击。与HSCT中细胞因子风暴相关的主要有IFN-γ、IL-1/2/6/23/12、TNF。因此,目前针对GvHD的治疗集中在对IL-2、IFN-信号通路,以及IL-6、JAK等通路的信号抑制上。其中,IL-2R拮抗剂的疗效和安全性已经得到广泛证实。
(二)实体器官移植
早期在肝移植及肝肾联合移植(CLKT)术后有细胞因子风暴相关病例报道,且这些病例有些是与抗体类药物的应用有关,如ATG、抗CD52,有的则是术后继发病毒感染导致(主要是人疱疹病毒包括EBV、CMV、HHV-8等)。
小编就这些病例与业界资深人士探讨后认为鲜有报道最可能的原因也许在于:外来的抗原暴露度不足以激活全身性的抗排斥反应,尽管肝肾联合移植手术复杂,其供体缺血再灌注损伤时间的延长可能导致更多抗原释放,但随着持续肾脏替代治疗(CRRT)技术的不断改进,已经很大程度减少了急性排斥反应带来的细胞因子风暴的可能性。
另一方面,移植患者术后使用免疫抑制剂,较容易感染病毒或者发生病毒再激活,理论上而言病毒抗原(很可能是主要原因)与供者抗原的共同刺激,也可能会引起细胞因子风暴的发生。然而实际临床中依然少见报道,除去移植术后患者常规预防性用药因素外,是否还有其它原因呢?
2008年的AJT发表了一篇关于移植患者感染CMV引起病毒血症的文章,研究者发现患者体内病毒特异性T细胞PD-1表达明显上调,且IL-2丢失。PD-1是T细胞活化和效应阶段的抑制性共刺激信号,它的高表达直接导致这些在适应性免疫中的抗病毒的“主力军”——CMV特异性T细胞出现与肿瘤患者体内类似的现象,即对抗原耐受或者无应答。当联合阻断PD-1/PD-L1与PD-L2后,这些CMV特异性T细胞方能产生大量IFN-γ启动抗病毒效应,后来类似的现象也陆续被报道。但是,阻断PD-1通路的同时也可激活大量T细胞,患者有非常大的几率出现严重的移植物排斥反应。
尽管在实体器官移植后,患者很少发生细胞因子风暴,但病毒感染或病毒再激活依然会导致其它不良结局,例如急性排斥反应和移植物衰竭。那么,如何在保证移植物功能正常的同时最大可能的帮助移植受者抵抗外界病原微生物的侵袭?特异性细胞因子阻断剂和受体拮抗剂可能有一定作用,目前也有移植受者接受免疫检查点抑制剂治疗的尝试,有成功的,但更多的是失败,故寻求更特异性的靶点也许是未来新的探索方向,同时在临床实践中应对边缘供体和高危受者做好风险评估,合理选择免疫诱导和维持方案。
参考文献见原文地址:https://mp.weixin.qq.com/s/_2v4R865z2H8rFPN_dK0cg
|
|